Over tumoren, bloedvaten en angiogenese
Kanker vormt al jaren één van de belangrijkste doodsoorzaken. Wereldwijd stierven er in 2004 zo’n 7,4 miljoen mensen aan kanker. Ondanks grote vooruitgang in de ontwikkeling van verschillende therapieën voor kanker, verwacht men dat dit aantal zal stijgen tot 12 miljoen in 2030. Deze cijfers van de World Health Organization geven aan dat verbetering van de huidige kankertherapieën nog steeds noodzakelijk is. Naast de conventionele therapeutische strategieën, zoals het chirurgisch verwijderen van de tumor, chemotherapie en bestraling, die zich vooral richten op de tumorcellen zelf, zijn er nieuwe therapieën in ontwikkeling die zich richten op de bloedvaten van een tumor.
De groei van tumoren is in zeer grote mate afhankelijk van de (nieuw)vorming van bloedvaten, een proces dat we angiogenese noemen. Immers, zonder goede bloedvoorziening, dus zonder aanvoer van zuurstof en voedingsstoffen, en zonder afvoer van afvalstoffen kunnen cellen niet overleven. Bovendien spelen bloedvaten een belangrijke rol bij het ontstaan van uitzaaiingen, waarbij tumorcellen via de bloedbaan getransporteerd worden naar andere organen. Al deze aspecten maken het proces van tumorbloedvatvorming een aantrekkelijk doelwit voor therapie.
Het vormen van een bloedvat is een complex proces. Een scala aan groeifactoren, receptoren, adhesiemoleculen, proteases en moleculen die zorgen voor de transductie van signalen van de ene cel naar de andere en ook binnen een cel, leiden het proces van nieuw-vorming van bloedvaten in de juiste banen. Het proces van angiogenese omvat verschillende stadia. Allereerst worden de cellen die de bloedvatwand bekleden, de endotheelcellen, geactiveerd door groeifactoren. Proteases zorgen ervoor dat het weefsel om de bloedvaten heen afgebroken wordt. De endotheelcellen krijgen daardoor de ruimte om te delen en te migreren in de richting waar het nieuwe zijtakje van het bloedvat gevormd gaat worden. De nieuwgevormde endotheelcellen moeten dan een buisachtige structuur vormen die aansluiting vindt op een bestaand bloedvat, zodat het onderdeel wordt van de bloedcirculatie. Tenslotte worden er pericyten, spiercelachtige steuncellen, gerekruteerd die het bloedvat ondersteunen. De endotheelcellen komen hierdoor weer terug in hun rusttoestand. Dit laatste noemen we vasculaire stabilisatie. Fysiologische angiogenese leidt tot de vorming van functionele bloedvaten, echter, pathologische angiogenese, zoals dat voorkomt in tumoren, kan leiden tot abnormale, slecht functionerende bloedvaten. In tegenstelling tot gezonde bloedvaten, worden tumorbloedvaten gekenmerkt door hun verwijde en bochtige karakter, sterke variaties in diameter, onvolledige bedekking met pericyten en grotere permeabiliteit, wat kan leiden tot chaotische bloeddoorstroming.
Eén van de moleculen die binnen het proces van angiogenese een sleutelrol speelt is vascular endothelial growth factor (VEGF). Deze groeifactor wordt onder andere door de tumorcellen geproduceerd. Door binding aan zijn receptor ‘VEGF-receptor 2’ (VEGFR2), welke zich op het celmembraan van de endotheelcellen bevindt, stimuleert VEGF de activatie van endotheelcellen, waardoor deze gaan delen en migreren. Bovendien zorgt VEGF voor verhoogde permeabiliteit van de bloedvaten, waarmee het vooral een rol speelt bij de initiatie van angiogenese. Bij de latere fases van angiogenese, de vaatstabilisatie en het versterken van interacties tussen endotheelcellen en pericyten, spelen weer andere moleculen een rol.
Antiangiogene therapie voor kanker
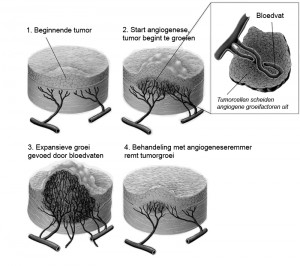
De afhankelijkheid van tumoren van een goede bloedvoorziening maakt dat het proces van angiogenese een goed aangrijpingspunt is voor kankertherapie. In theorie kan de groei van tumoren, en ook de vorming van uitzaaiingen worden geremd door de groei van bloedvaten in een tumor te blokkeren (Fig 1). Dit principe is in het begin van de jaren ’70 geïntroduceerd door Dr. Judah Folkman (Harvard Medical School, Boston). Hij ontdekte dat tumorcellen stofjes afgeven die de groei van bloedvaten stimuleren, en daarmee een interessant aangrijpingspunt voor therapie vormen. De ontdekking van VEGF als één van de belangrijkste tumorangiogenese-stimulerende stoffen door Dr. Harold Dvorak (Harvard Medical School) leidde tot een sterke opmars in de ontwikkeling van geneesmiddelen die interfereren met de functie van VEGF of zijn receptor VEGFR2.
Figuur 1: Tumoren zijn voor groei afhankelijk van angiogenese, remming van angiogenese vormt daarom een veelbelovende therapie voor kanker. Figuur is in aangepaste vorm overgenomen van J. Folkman ‘Fighting cancer by attacking its blood supply’, Scientific American, Sept 1996.Het blokkeren van tumorgroei wordt sindsdien gezien als een zeer veelbelovende strategie bij kanker en inmiddels heeft de Amerikaanse Food and Drug Administration (FDA) tien geneesmiddelen die de effecten van VEGF blokkeren goedgekeurd. Dat deze therapieën effectief kunnen zijn, is gebleken uit een aantal klinische studies. Echter, in het algemeen zijn de antitumor effecten in de kliniek beperkt, en er zijn zelfs kankertypes bekend die niet op deze therapie reageren. Een van de redenen die hieraan ten grondslag zou kunnen liggen, is de grote mate van heterogeniteit onder tumorbloedvaten. Het merendeel van de huidige angiogenese-remmers richt zich alleen op VEGF, dat vooral een rol speelt bij beginstadia van angiogenese. Bloedvaten die zich al in eindstadia van vorming bevinden, en dus minder afhankelijk zijn van VEGF, zullen daardoor minder gevoelig zijn voor deze therapie. Daarnaast is er sprake van een grote variatie in bloedvaten tussen verschillende typen tumoren, en zelfs binnen eenzelfde tumor kunnen bloedvaten sterk variëren. Deze heterogeniteit uit zich in variaties in morfologie en architectuur van de vaten, variaties in functie, zoals permeabiliteit, en variaties in expressie van genen die endotheelgedrag bepalen. Dit maakt dat verschillende tumorbloedvaten verschillend zullen reageren op farmacotherapie.
In hoofdstuk 2 van mijn proefschrift hebben we een overzicht gegeven van wat er bekend is in de literatuur omtrent heterogeniteit van bloedvaten in het algemeen, en van tumorbloedvaten in het bijzonder. Daarnaast zijn we in hoofdstuk 2 ingegaan op de huidige kennis van de exacte effecten van angiogenese-remmers op tumorbloedvaten, en hoe deze effecten op de endotheelcellen relateren met het antitumor-effect dat de remmers teweeg brengen.
Doelstelling van mijn proefschrift
Om verbeterde antiangiogene therapieën te kunnen ontwikkelen is het van groot belang meer inzicht te verkrijgen in het moleculaire fenotype van tumorbloedvaten, en de veranderingen die hierin optreden als gevolg van behandeling met angiogenese-remmers. Hoe zien de bloedvaten in een groeiende tumor er morfologisch uit en welke genen brengen ze tot expressie? Hoe verandert de morfologie en het moleculaire profiel van deze bloedvaten als gevolg van behandeling met een angiogenese-remmer? En hoe staan deze veranderingen in relatie tot het uiteindelijke antitumor effect van de angiogeneseremmer, of juist de afwezigheid daarvan? Antwoorden op deze vragen zijn noodzakelijk om het wel of niet effectief zijn van deze geneesmiddelen beter te kunnen begrijpen, en dragen daarmee bij aan de ontwikkeling van verbeterde therapeutische strategieën.
In mijn proefschrift hebben we de morfologie en het moleculaire profiel van tumorbloedvaten (het fenotype) in vivo in een groeiende tumor in detail bestudeerd. Daarnaast hebben we onderzocht hoe activatie van endotheelcellen de effectiviteit van antiangiogene therapie beïnvloedt. Tenslotte hebben we onderzocht hoe antiangiogene therapie het fenotype van bloedvaten in de tumor verandert, en hoe deze veranderingen in relatie staan tot het antitumor effect. Tijdens het onderzoek is gebruik gemaakt van endotheelcellen in kweek (‘in vitro’ = in glas), en van endotheel in twee verschillende muismodellen voor kanker, een melanoom (huidkanker) en een longcarcinoom.
Moleculaire karakterisering van tumor bloedvaten in vivo.
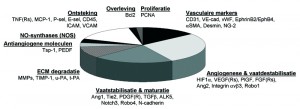
Centraal in ons onderzoek staat de hypothese dat endotheelcellen zich in verschillende stadia van angiogenese bevinden, en daardoor verschillend gevoelig zijn voor therapie. Wij verwachtten dat die verschillende stadia van angiogenese zouden leiden tot variaties in morfologie van de tumorbloedvaten, en variaties in expressie van moleculen die het proces van angiogenese reguleren. Daarom hebben we in Hoofdstuk 3 het profiel van expressie van een groot aantal angiogenese-regulerende genen onderzocht in drie verschillende groeistadia van een melanoommodel in de muis (het zogenaamde B16.F10 melanoma). Een overzicht van de genen die wij hebben geanalyseerd is te vinden in Figuur 2. De drie verschillende groeistadia van het melanoom waren gedefinieerd op basis van tumor volume: kleine tumoren (~25 mm3), intermediaire tumoren (~180 mm3) en grote tumoren (~525 mm3). Hoewel de morfologie van de bloedvaten gedurende tumorgroei drastisch veranderde, werden de drie groeistadia, in tegenstelling tot onze verwachtingen, gekenmerkt door eenzelfde profiel van angiogenese-regulerende moleculen. Om in meer detail naar het endotheel alleen te kunnen kijken, hebben we dit geïsoleerd van het omliggende tumorweefsel door laser microdissectie (Fig 3). Daaruit bleek dat, zelfs wanneer we het endotheel van hele kleine bloedvaten zonder zichtbaar lumen vergeleken met dat van grote bloedvaten met wijd open lumen, deze typen bloedvaten, ondanks hun morfologische verschillen evenwel hetzelfde profiel van genexpressie hadden.
Figuur 2: Een overzicht van de genen die we hebben geanalyseerd in tumorbloedvaten.Vervolgens hebben we het endotheel van tumorbloedvaten vergeleken met dat van bloedvaten (venules) in een gezonde nier, als voorbeeld van ‘rustend’ endotheel dat niet bij angiogenese betrokken is. Hieruit bleek dat alle genen met een angiogenesestimulerende functie verhoogd tot expressie werden gebracht in het tumorendotheel, terwijl genen met een angiogenese-remmende en bloedvat-stabiliserende functie sterker geproduceerd werden door het rustende endotheel in de nier. Deze data laten zien dat er actieve angiogenese plaatsvindt in het melanoom, en dat dit proces van angiogenese zowel in het begin van de tumorgroei als wanneer de tumor groot is door dezelfde genen gereguleerd blijft.
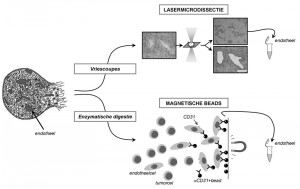
Figuur 3: Twee verschillende methodes voor het isoleren van endotheelcellen. Endotheelcellen omvatten slechts een klein percentage van de totale celpopulatie in een weefsel. Om het gedrag van deze cellen binnen een tumor te kunnen onderzoeken, is het belangrijk de endotheelcellen van hun omliggende tumorweefsel te isoleren. In dit proefschrift zijn hiervoor twee verschillende methodes gebruikt. Bij de eerste methode, lasermicrodissectie, wordt door middel van een laser het endotheel uit coupes van ingevroren tumoren gesneden, en apart opgevangen. Het figuur laat het beeld van tumorweefsel onder de laserdissectiemicroscoop zien (vergroting 400x), voor en na het laseren van het endotheel. Het beeld rechtsboven geeft de opbrengst van het endotheel na het laseren weer. Bij de tweede methode worden tumoren na het oogsten in kleine stukjes gesneden en wordt het weefsel met collagenase gedigesteerd, waardoor een suspensie van losse tumorcellen, endotheelcellen en eventueel ook tumor-infiltrerende cellen, zoals immuuncellen, ontstaat. Magnetische beads die geconjugeerd zijn met een antilichaam tegen CD31, een molecuul dat alleen door endotheelcellen wordt geproduceerd, worden aan deze suspensie toegevoegd en binden aan de endotheelcellen. Met een magneet kunnen dan de endotheelcellen van de overige cellen gescheiden worden.Tegen onze verwachting in kon heterogeniteit van het endotheel in dit model niet aangetoond worden. Echter, een beperking van dit model is dat tumorgroei plaatsvindt in een onderhuids gebied waar nauwelijks bloedvaten zijn, en waar de tumor dus volledig afhankelijk is van angiogenese, in tegenstelling tot veel (humane) tumoren die in vaatrijke gebieden groeien. Bovendien is de groeisnelheid van deze tumor exponentieel, terwijl humane tumoren juist veel variatie in groeisnelheid kennen. Daarom is het aannemelijk dat endotheelheterogeniteit in de kliniek een belangrijkere rol speelt dan in dit muizenmodel.
Een ‘in vitro’ benadering voor ‘in vivo’ farmacologie
In een groeiende tumor waar actieve angiogenese plaatsvindt, is het aannemelijk dat endotheelcellen zich in verschillende activatiestadia van angiogenese bevinden. Het is zeer waarschijnlijk dat cellen die eenmaal geactiveerd zijn door VEGF minder ontvankelijk zijn voor remming van de VEGF-receptor, immers, alle processen die door VEGF in de cel worden geactiveerd zijn op dat moment al in gang gezet. Echter, de meeste studies naar geneesmiddeleffecten in vitro zijn tot nu toe uitgevoerd in rustende cellen, waardoor dit aspect buiten beschouwing werd gelaten.
In Hoofdstuk 4 hebben we de ‘in vivo’ situatie van geactiveerde cellen nagebootst in ons ‘in vitro’ systeem door de endotheelcellen te activeren met VEGF alvorens een VEGFR2-remmer toe te dienen. Op deze manier hebben we onderzocht wat de gevolgen zijn van ‘late’ behandeling van cellen in geactiveerde toestand voor de effectiviteit van de therapie. Als VEGFR2-remmer hebben we gebruik gemaakt van vandetanib (ZD6474/Zactima), een geneesmiddel dat de fosforylering, en daarmee de activatie, van VEGFR2 voorkomt (Fig 4). Als uitleesmaat voor effectiviteit van therapie hebben we gekeken in hoeverre de remmer in staat was om de inductie van bepaalde genen door VEGF te remmen. De resultaten lieten zien dat wanneer de VEGFR2-remmer ná activatie aan de endotheelcellen werd toegediend, deze minder effectief de inductie van deze genen kon remmen dan wanneer de remmer vóór activatie werd toegediend. Dat betekent dat endotheelcellen die zich eenmaal in angiogeen-actieve toestand bevinden, minder ontvankelijk zijn voor dit geneesmiddel dan rustende endotheelcellen.
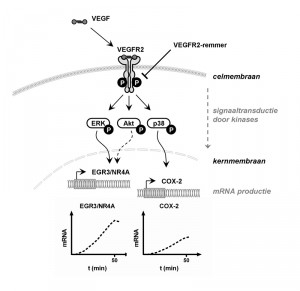
Figuur 4: Schematische weergave van de effecten die VEGF teweeg brengt in een endotheelcel. VEGF bindt aan zijn receptor VEGFR2 op het membraan van de endotheelcel. Binding van VEGF aan de receptor zorgt dat deze gefosforyleerd wordt (aangegeven met P), waardoor deze in geactiveerde toestand raakt. VEGFR2 geeft het activatiesignaal door naar de celkern door zogenaamde kinases (eiwitten) te activeren (fosforyleren), die vervolgens weer andere kinases activeren. De drie belangrijkste kinaseroutes die door VEGF worden geactiveerd zijn ERK, Akt en p38. Deze kinases geven het signaal door tot in de kern, waar de productie van mRNA van een groot arsenaal aan genen geactiveerd wordt. Drie (families van) genen die zeer snel reageren – genen waarvan het mRNA binnen 50 minuten na toediening van VEGF te meten is – zijn EGR3, NR4A en COX-2. Op dezelfde wijze reguleert VEGF op de langere termijn de productie van een groot scala aan andere eiwitten die een belangrijke rol in het proces van angiogenese spelen. De in onze studie gebruikte VEGFR2-remmer voorkomt fosforylatie van VEGFR2 na binding van VEGF, en voorkomt daarmee dat al deze processen in gang worden gezet.Om beter te begrijpen wat de onderliggende moleculaire mechanismen zijn van deze verlaagde effectiviteit, hebben we gekeken naar de activatie van kinases die een belangrijke schakel vormen in de signaaltransductie van VEGF (Fig. 4). We hebben onderzocht wat de effecten zijn van behandeling met vandetanib op de kinetiek van fosforylering van VEGFR2 en de kinases ERK, Akt en p38. Activatie van endotheelcellen met VEGF leidde tot fosforylering van VEGFR2 en ERK, welke effectief geremd werden als de VEGFR2-remmer vóór activatie was toegediend aan de cellen. Echter, wanneer de cellen met VEGFR2-remmer behandeld werden ná activatie met VEGF, werden fosforylering van VEGFR2 en ERK niet meer of pas na enige tijd geremd. Dit suggereert dat een angiogeen-actieve endotheelcel voor een korte tijd na VEGF-activatie ongevoelig is voor behandeling met een VEGFR2-remmer.
Moleculaire aspecten van antiangiogene therapie.
Naast effecten van therapie op VEGFR2 signaaltransductie in de endotheelcellen, is het ook van belang om meer inzicht te verkrijgen in de effecten van therapie op morfologie en genexpressie van de bloedvaten in de tumor. Hiervoor hebben we in Hoofdstuk 5 muizen met een subcutaan groeiende longtumor (het zogenaamde Lewis Lung Carcinoma) langdurig behandeld met de VEGFR2-remmer vandetanib. De endotheelcellen hebben we uit tumorweefsel geïsoleerd door middel van magnetische beads die geconjugeerd waren met een antilichaam tegen CD31, een molecuul dat specifiek door endotheelcellen wordt geproduceerd (Fig. 3). Behandeling met vandetanib veroorzaakte een drastische 80% remming van de tumorgroei. Dit ging gepaard met een verschuiving in het genexpressieprofiel naar verlaagde productie van een aantal pro-angiogene moleculen, zoals integrine β3 en Robo1, en verhoogde productie van een aantal vaatstabiliserende moleculen, zoals Tie2, Notch3 en N-cadherine (zie Fig. 2) door het endotheel. Bovendien leidde behandeling met vandetanib tot versterking van de interacties tussen endotheelcellen en pericyten. De verschuiving naar verhoogde vasculaire stabilisatie trad al binnen enkele uren na het toedienen van de eerste dosis op, zoals bleek uit genexpressieanalyses van tumorbloedvaten kort na het toedienen van een enkele dosis. Dit betekent dat vandetanib in dit longtumormodel zijn antitumor effect bewerkstelligt door angiogenese te remmen en vaatstabilisatie te stimuleren.
In Hoofdstuk 6 hebben we de moleculaire effecten van behandeling met vandetanib op het tumorendotheel van twee verschillende tumormodellen met elkaar vergeleken. Naast muizen met het longcarcinoom, hebben we nu ook muizen met het subcutaan groeiende melanoom (B16) behandeld met vandetanib. In dit geval hebben we van beide tumor typen de endotheelcellen geïsoleerd door middel van lasermicrodissectie (Fig. 3). Hoewel in beide tumormodellen eenzelfde tumorgroei-remmend effect werd gezien, ging deze in het melanoom-model gepaard met een significante verlaging van de vaatdichtheid, terwijl dat in het longkankermodel niet het geval was. En waar een verschuiving van het moleculaire profiel richting vaatstabilisatie ten grondslag lag aan het antitumor effect in het longcarcinoom, veroorzaakte VEGFR2-remming in het melanoom hele andere veranderingen in het moleculaire profiel. Deze data laten zien dat, hoewel de uitkomst van therapie hetzelfde kan zijn, de onderliggende moleculaire veranderingen die dit antitumor effect veroorzaken per tumortype sterk kunnen verschillen.
Een buitengewoon interessante observatie was dat eiwitexpressie van VEGFR2 op de bloedvaten na therapie in beide tumormodellen sterk verlaagd was. Omdat verlies van deze receptor, het aangrijpingspunt van de therapie, grote gevolgen kan hebben voor de effectiviteit van VEGFR2-remmers in de kliniek, is het van groot belang om dit verder te onderzoeken in humane tumorbiopten.
Conclusies van dit onderzoek
Antiangiogene therapie is een veelbelovende behandelmethode voor kanker, echter, verbetering van de effectiviteit van dergelijke behandelingsstrategieën vereist meer inzicht in het moleculaire gedrag van de doelwitcellen, het endotheel, en de veranderingen die hierin optreden als gevolg van behandeling met antiangiogene therapie. In mijn proefschrift laten we zien dat in verschillende stadia van een onderhuids groeiend melanoom actieve angiogenese plaatsvindt, dat in de tijd gereguleerd wordt door hetzelfde repertoire van pro-angiogene moleculen. Als men ‘te laat’ tumorendotheelcellen, die zich al in een angiogeen-actieve status bevinden, blootstelt aan een VEGFR2-remmer, zijn deze cellen korte tijd na activatie verminderd gevoelig voor de therapie. In het longcarcinoommodel gaat tumorgroei-remming gepaard met een verschuiving in het moleculaire profiel naar verhoogde vaatstabilisatie en versterkte interacties tussen endotheelcellen en hun steungevende pericyten. In het melanomamodel liggen echter hele andere moleculaire veranderingen in het endotheel ten grondslag aan het antitumor effect. In beide modellen leidt behandeling bovendien tot sterk verlaagde expressie van de doelwitreceptor. Het is van groot belang deze bevindingen verder te onderzoeken in humane tumor biopten. Bovendien toont de variatie in respons op geneesmiddelbehandeling aan dat de moleculaire effecten van antiangiogene therapie in relatie tot effectiviteit voor elk tumortype in de kliniek apart geëvalueerd moeten worden.
Het onderzoek beschreven in mijn proefschrift laat zien dat één van de belangrijkste hindernissen die voor het onderzoek naar antiangiogene therapie genomen moet worden, het ontwikkelen van betere modellen voor angiogenese en kanker is. Elk angiogenese-model is een model op zich en daarmee geen goede reflectie van de situatie in de kliniek. Endotheelcellen in kweek zijn uit hun natuurlijke context gehaald en missen daarom de invloeden van de omliggende pericyten en tumorcellen. Zelfs de subcutaan groeiende tumormodellen geven slechts een beperkte weergave van de heterogeniteit in angiogeen gedrag van klinische tumoren. Dit maakt het ingewikkeld om bevindingen in muizenmodellen te extrapoleren naar de kliniek. De uitdaging voor de toekomst ligt daarom in het ontwerpen van tumormodellen die beter de humane situatie nabootsen.
Een blik op de toekomst
In mijn proefschrift hebben we ons gericht op de analyse van zo’n 50 moleculen die een rol spelen bij angiogenese. Deze zijn in de literatuur bekend als de belangrijkste regulatoren van dit proces. Echter, meer en meer moleculen worden geïdentificeerd die mogelijk bij angiogenese betrokken zijn. Een completer beeld van het werkingsmechanisme van antiangiogene therapie vraagt daarom een genoombrede benadering. Idealiter worden dergelijke grootschalige screens die de expressie en/of activiteit van tienduizenden genen en kinases kunnen analyseren gecombineerd met lasermicrodissectie van een selectie van bloedvaten, zodat specifiek díe bloedvaten geanalyseerd kunnen worden die inderdaad hebben gereageerd op de therapie. Dergelijke informatie zal aan de ene kant kunnen bijdragen aan de ontwikkeling van verbeterde therapeutische strategieën, bijvoorbeeld gericht op meerdere aangrijpingspunten in verschillende stadia van het angiogenese proces. Aan de andere kant zal dit kunnen bijdragen aan de ontwikkeling van biomarkers voor effectiviteit van therapie. Zulke biomarkers zijn moleculen die als gevolg van therapie versterkt of verminderd door het endotheel geproduceerd worden en in de bloedbaan worden uitgescheiden, zodat ze meetbaar zijn in het serum van patiënten. Op basis van deze biomarkers kan effectiviteit van de therapie gedurende de behandeling geanalyseerd worden, of kan voorspeld worden of een patiënt al dan niet op een bepaalde antiangiogene therapie zal reageren.
Gezien de variatie tussen tumoren en hun moleculaire reactie op therapie, kunnen we stellen dat succesvolle antiangiogene therapie in de kliniek waarschijnlijk voor iedere patiënt een persoonlijke therapeutische benadering vereist. Zulke ‘personalized medicine’ therapeutische strategieën kunnen alleen ontworpen worden als men goede pre-klinische modellen, goede biomarkers voor effectiviteit en goede beeldvormende technieken voor tumorgroei en angiogenese ter beschikking heeft.
From: ‘Molecular Characterization of tumor vascular phenotype and pharmacology of antiangiogenic therapy’ by Elise Langenkamp. ISBN 978-90-367-4681-6 / 978-90-367-4680-9.
© Elise Langenkamp, 2010.